细胞的电活动
细胞在进行生命活动时都伴随有电现象,称为细胞生物电(bioelectricity)。
细胞生物电是由一些带电离子(如Na+、K+、Cl-、Ca2+等)跨膜流动而产生的,表现为一定的跨膜电位(transmembrane poten- tial),简称膜电位(membrane potential)。
细胞的膜电位主要有两种表现形式,即安静状态下相对平稳的静息电位和受刺激时迅速发生、并向远处传播的动作电位。机体所有的细胞都具有静息电位,而动作电位则仅见于神经细胞、肌细胞和部分腺细胞。
临床上诊断疾病时广泛应用的心电图、脑电图、肌电图、胃肠电图和视网膜电图等是在器官水平上记录到的生物电,它们是在细胞生物电活动基础上发生总和的结果。
一、静息电位
(一)静息电位的测定和概念
静息状态下存在于细胞膜两侧的内负外正的电位差,称为静息电位(resting potential,RP)。
据测定,当细胞外液固定于零电位时,各类细胞的膜内电位在安静情况下均为负值,范围在-10~-100mV之间,如在骨骼肌细胞约为-90mV,神经细胞约-70mV,平滑肌细胞约-55mV,红细胞约-10mV。
生理学中,通常将安静时细胞膜两侧处于外正内负的稳定状态称为极化(polarization)。
当细胞受到刺激时,静息电位可发生改变。另外,某些中枢神经元和具有自律性的心肌、平滑肌细胞可出现自发性的静息电位波动。
- 静息电位增大(如细胞内电位由-70mV变为-90mV)表示膜的极化状态增强,这种静息电位增大的过程或状态称为超极化(hyperpolarization);
- 静息电位减小(如细胞内电位由-70mV变化为-50mV)的过程或状态称为去极化(depolarization);
- 膜内电位变为正值、膜两侧极性倒转的状态称为反极化(reverse polarization);
- 细胞膜去极化后再向静息电位方向恢复的过程则称为复极化(repolarization)。
(二)静息电位的产生机制
静息电位形成的基本原因是带电离子的跨膜转运,而离子跨膜转运的速率取决于该离子在膜两侧的浓度差和膜对它的通透性。
1.细胞膜两侧离子的浓度差与平衡电位
细胞膜两侧离子的浓度差是引起离子跨膜扩散的直接动力。该浓度差是由细胞膜中的离子泵,主要是钠泵的活动所形成和维持的(见前)。
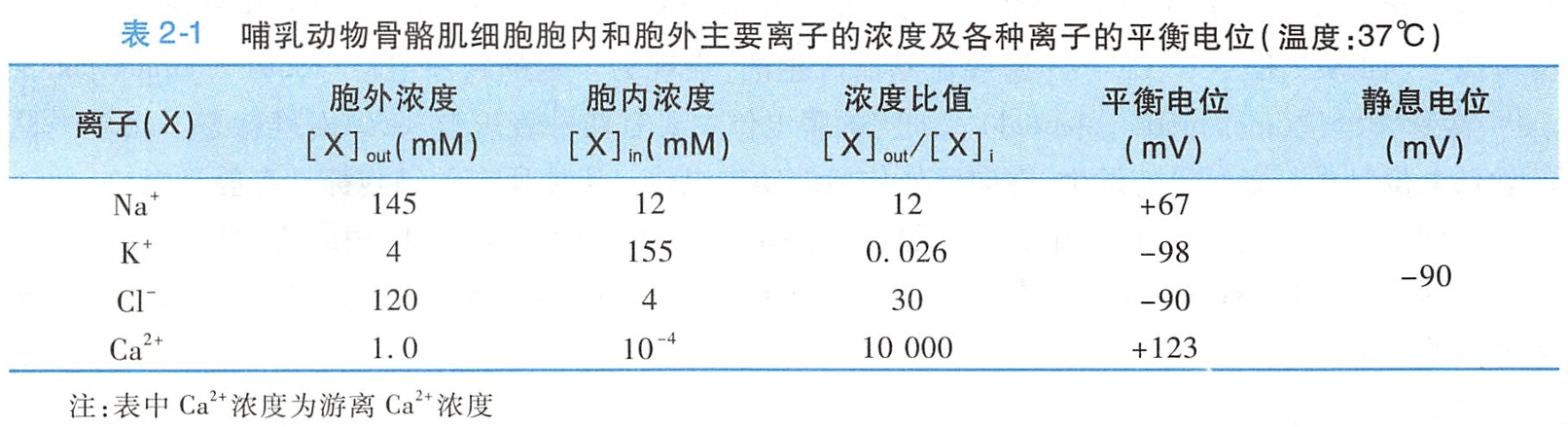
表2-1显示的是哺乳动物骨骼肌膜两侧的离子浓度,其中细胞外液的Na+浓度为细胞内液Na+浓度的12倍左右;而细胞内液K+浓度为细胞外液K+浓度的30倍左右。
在这种情况下,若质膜只对一种离子如K+有通透性,K+将在浓度差的驱动下从细胞内向细胞外扩散,同时膜内带负电荷的有机离子因细胞膜对它们几乎不通透而聚积在膜的内表面,从而将外流的K+限制于膜的外表面。由此,膜的内外表面之间便产生了内负外正的电位差,即K+扩散电位(图2-14A)。
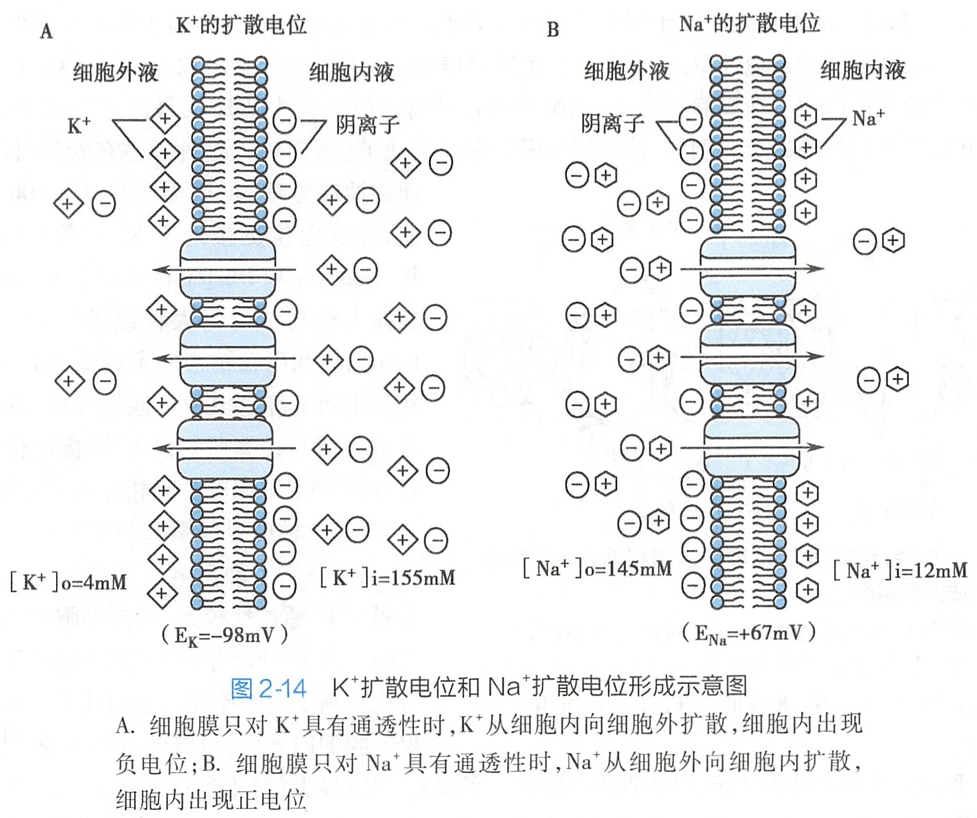
同理,若质膜只对Na+有通透性,Na+离子将在浓度差的驱动下从细胞外向细胞内扩散,产生内正外负的Na+扩散电位(图2-14B)。
扩散电位形成的跨膜电场对带电离子跨膜移动的作用与浓度差作用正好相反,将阻止该离子的继续扩散。
跨膜电场和离子浓度差这两个影响带电离子移动的驱动力的代数和称为离子的电-化学驱动力(electrochemical driving force)。当电位差驱动力增加到与浓度差驱动力相等时,电-化学驱动力即为零,此时该离子的净扩散量为零,膜两侧的电位差便稳定下来(图2-14)。
这种离子净扩散为零时的跨膜电位差称为该离子的平衡电位(equilibrium potential)。利用Nernst公式 #无机化学 ,便可计算出某种离子的平衡电位,即
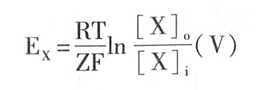
式中Ex为某离子(X)的平衡电位(以细胞外为零电位的细胞内数值,单位为伏特),R为气体常数,T为绝对温度,F为法拉第常数,Z为离子价数,[X]o和[X]i分别为该离子在细胞外液和细胞内液中的浓度。
如果离子X为正1价,环境温度为29.2℃,将自然对数转换为常用对数以及Ex的单位用mV表示时,则上述Nernst公式可表示为
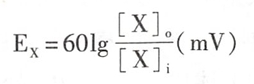
从该公式可以看出,对于任何单价离子来说,膜两侧10倍浓度差产生的化学驱动力需要大约 60mV的电位差来平衡。浓度相差愈大,平衡电位愈大。而且,当[X]o>[X]i时(如Na+或Ca2+),其平衡电位为正值;当[X]o<[X]i时(如K+),其平衡电位为负值。
在哺乳动物体内温度(37℃)条件下,该公式的系数为61.5mV。若将膜两侧溶液中的离子浓度分别代入式中,可计算出各种离子的平衡电位,如K+平衡电位(K+ equilibrium potential,Ek)、Na+平衡电位(Na+ equilibrium potential,ENa)等(表2- 1)。
一般来说,哺乳动物多数细胞的Ek为-90~-100mV,ENa为+50~+70mV。
2.静息时细胞膜对离子的相对通透性
细胞膜在安静状态下如果只对一种离子具有通透性,那么实际测得的静息电位应等于该离子的平衡电位;如果安静状态下细胞膜对几种或多种离子同时具有通透性,静息电位的大小则取决于细胞膜对这些离子的相对通透性和这些离子各自在膜两侧的浓度差。
膜对某种离子的通透性愈高,该离子的扩散对静息电位形成的作用就愈大,静息电位也就愈接近于该离子的平衡电位。
在安静状态下,细胞膜对各种离子的通透性以K+为最高,因为细胞膜中存在持续开放的非门控钾通道。例如,神经细胞膜中有钾漏通道(图2-15),这种通道在安静时对K+的通透性约为对Na+通透性的50~100倍。
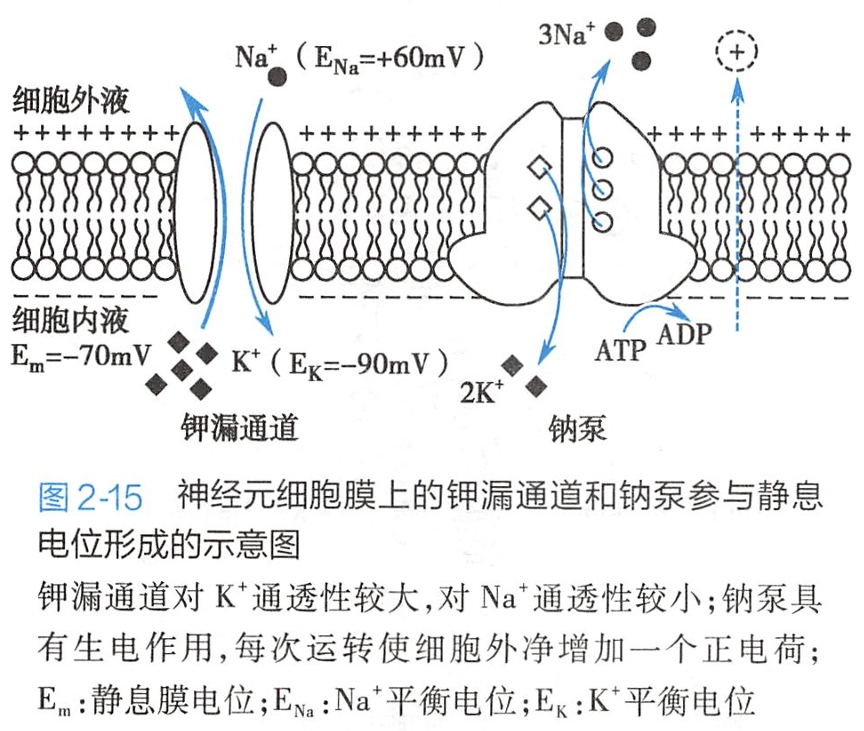
因此,静息电位更接近于K+平衡电位。
改变膜两侧K+浓度梯度也能引起静息电位的相应改变,从而证实了静息电位主要是由安静时细胞膜对K+通透性较大,K+向细胞外扩散而形成的。在K+外流过程中,膜内侧带负电荷的有机负离子因细胞膜对它们几乎不通透而积聚于膜的内表面,可将外流的K+限制在膜的外表面,形成一个厚度不足1nm的极薄的电偶层。
实际上,只需极少量(不足百万分之一!)的K+外流即可使膜电位接近K+的平衡电位,达到静息电位水平。这样,当某些细胞形成动作电位时,也就只需少量的Na+内流即可逆转膜的极化状态(见后文)。
然而,静息电位的实测值并不等于K+平衡电位,而是略小于K+平衡电位(指绝对值)。如表2-1中所示,骨骼肌细胞静息电位(-90mV)小于其K+平衡电位(-98mV);如图2-15所示,神经元静息电位(Em=-70mV)数值也小于其K+平衡电位(Ex=-90mV)。
静息电位略小于K+平衡电位的原因是,安静时细胞膜对Na+也有一定的通透性(为K+通透性的1/100~1/50),少量进入细胞的Na+可部分抵消由K+外流所形成的膜内负电位。因此,细胞膜的静息电位应当是根据膜对K+和Na+的通透性将K+平衡电位和Na+平衡电位赋予一定权重后的代数和,可用下式表示:
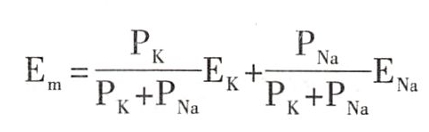
式中Em为静息电位,Pk和PNa分别为膜对K+和Na+的通透性,Ek和ENa为K+和Na+的平衡电位。它们的系数即权重因子为各自通透性占两者总通透性的比值。
膜两侧溶液中的离子还有Cl-和Ca2+和有机负离子等,但它们对静息电位的形成均无明显作用。
3.钠泵的生电作用
钠泵通过主动转运可以维持细胞膜两侧Na+和K+的浓度差,为Na+和K+的跨膜扩散形成静息电位奠定基础。每分解一分子ATP,钠泵可使3个Na+移出胞外,同时2个K+移入胞内,相当于把一个净正电荷移出膜外(见图2-15),结果使膜内电位的负值增大。因此,钠泵活动在一定程度上也参与静息电位的形成。
但一般来说,钠泵的生电作用对静息电位形成的贡献十分有限,在神经纤维可能不超过5%。
根据以上静息电位形成机制的分析,可见影响静息电位水平的因素主要有:
- 细胞外液K+浓度:在安静情况下,细胞膜对K+的通透性相对较大,改变细胞外K+浓度即可影响K+平衡电位和静息电位。当细胞外K+浓度升高时,K+平衡电位减小,静息电位也相应减小。临床上出现的高血钾可以强烈抑制心脏的兴奋和收缩功能,其原因就与高血钾引起静息电位减小,膜发生去极化进而使电压门控钠通道失活(见后文)有关。
- 膜对K+和Na+的相对通透性:如果膜对K+的通透性增大,静息电位将增大;反之,膜对Na+的通透性增大,则静息电位减小。
- 钠泵活动水平:钠泵活动增强时,其生电效应增强,膜发生一定程度的超极化;相反,钠泵活动受抑制时,则可使静息电位减小。
二、动作电位
(一)动作电位的概念及特点
动作电位(action potential,AP)是指细胞在静息电位基础上接受有效刺激后产生的一个迅速的可向远处传播的膜电位波动。
以神经细胞为例,当受到一个有效刺激时,其膜电位从-70mV逐渐去极化到达阈电位水平(见后文),此后迅速上升至+30mV,形成动作电位的升支(去极相);随后又迅速下降至接近静息电位水平,形成动作电位的降支(复极相)。
两者共同形成尖峰状的电位变化,称为锋电位(spike potential)。锋电位是动作电位的主要部分,被视为动作电位的标志。
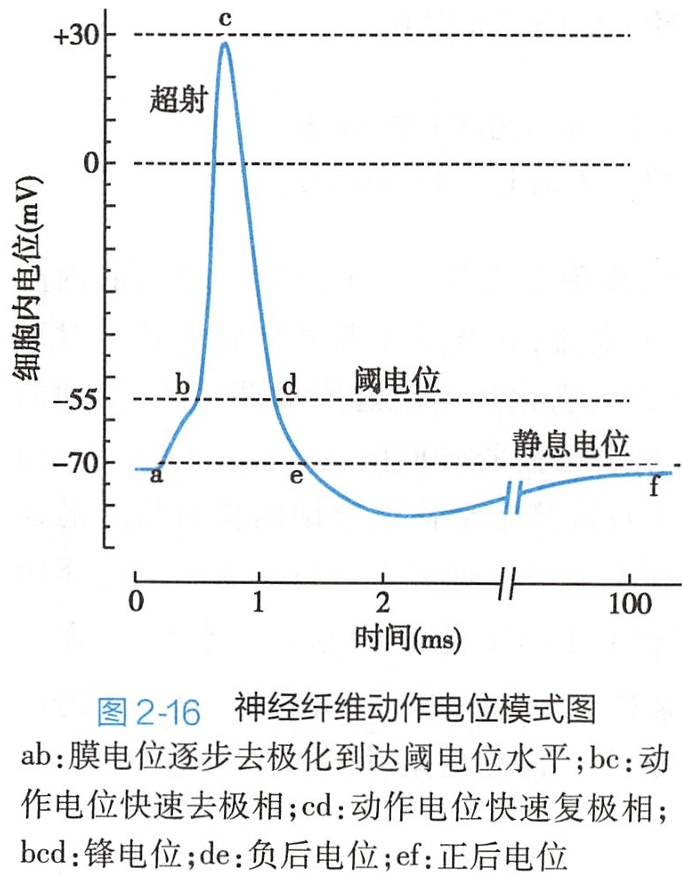
锋电位之后膜电位的低幅、缓慢波动,称为后电位(after potential)。后电位包括前后两个部分,前一部分的膜电位仍小于静息电位,称为后去极化电位(after depolarization potential,ADP);后一成分大于静息电位,称为后超极化电位(after hyperpolarization potential,AHP)。
如果沿用电生理学发展早期使用细胞外记录的方法对后电位命名,后去极化电位可称为负后电位(negative after-potential),后超极化电位可称为正后电位(positive after-potential)。后电位持续的时间较长,哺乳动物A类神经纤维的后电位可持续将近100毫秒。后电位结束后膜电位才恢复到稳定的静息电位水平(图2-16)。
不同细胞的动作电位具有不同的形态,如上述神经细胞的动作电位时程很短,锋电位持续时间仅约1毫秒;骨骼肌细胞的动作电位时程略长,为数毫秒,但波形仍呈尖峰状;心室肌细胞动作电位时程较长,可达300毫秒左右,主要是复极化时间长,期间形成一个平台(见第四章)。
动作电位具有以下特点:
- “全或无”现象:要使细胞产生动作电位,所给的刺激必须达到一定的强度。若刺激未达到一定强度,动作电位就不会产生(无);当刺激达到一定的强度时,所产生的动作电位,其幅度便到达该细胞动作电位的最大值,不会随刺激强度的继续增强而增大(全),这就是动作电位的“全或无”(alor none)现象。
- 不衰减传播:动作电位产生后,并不停留在受刺激处的局部细胞膜,而是沿膜迅速向四周传播,直至传遍整个细胞,而且其幅度和波形在传播过程中始终保持不变。
- 脉冲式发放:连续刺激所产生的多个动作电位总有一定间隔而不会融合起来,呈现一个个分离的脉冲式发放。
(二)动作电位的产生机制
离子跨膜转运需要两个必不可少的因素,一是离子的电-化学驱动力,二是细胞膜对离子的通透性。
动作电位的产生正是在静息电位基础上两者发生改变的结果。
1.电-化学驱动力及其变化
根据平衡电位的定义,当膜电位(Em)等于某种离子的平衡电位(Ex)时,这种离子受到的电-化学驱动力等于零。
因此,离子的电-化学驱动力可用膜电位与离子平衡电位的差值(Em-Ex)表示,差值愈大,离子受到的电-化学驱动力就愈大;数值前的正负号则表示离子跨膜流动的方向,正号为外向,负号为内向。
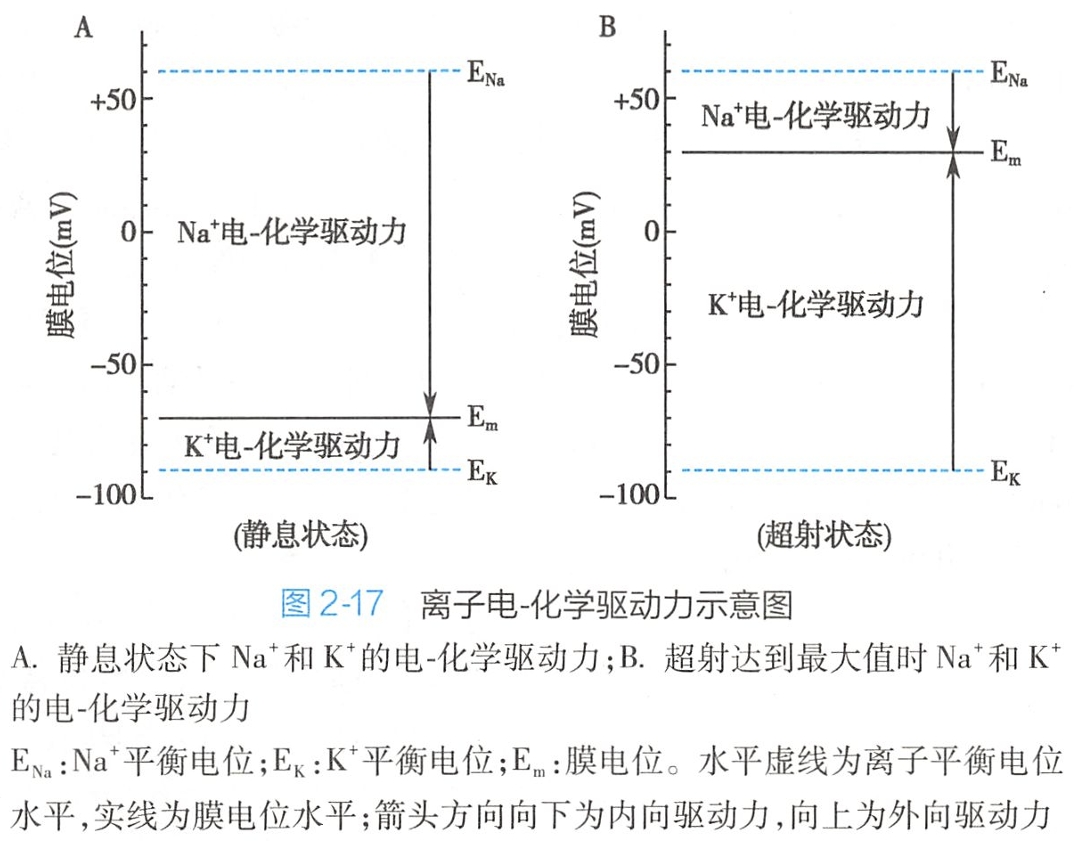
当细胞(以神经细胞为例)处于静息状态(图2-17A)时,根据静息膜电位(Em=-70mV)、Na+平衡电位(ENa=+60mV)和K+平衡电位(Ek=-90mV)的数值,可求得Na+的电-化学驱动力为-130mV,K+的电-化学驱动力为+20mV,
即安静情况下,Na+受到的内向驱动力明显大于K+受到的外向驱动力。
在动作电位期间,ENa和Ek基本不变,因为每次进出细胞的离子仅占总量的几万分之一,膜两侧的离子浓度差基本不受影响;但膜电位(Em)将随去极化和复极化发生大幅度改变。
因此,Na+和K+的电-化学驱动力在整个动作电位期间的每个瞬间都随膜电位的变化而变化。例如,当膜电位Em去极化至+30mV的超射值水平时(图2-17B),Na+电-化学的驱动力由原来静息时的-130mV减小为-30mV,而K+的电-化学驱动力则由原来静息时的+20mV增大到+120mV。
2.动作电位期间细胞膜通透性的变化
根据以上分析,细胞在安静时Na+已受到很强的内向驱动力,如果此时膜对Na+的通透性增大,将出现很强的内向电流(正离子由膜外向膜内转运时形成的电流),从而引起膜的快速去极化;细胞发生动作电位如去极化达到超射值水平时,K+受到的外向驱动力明显增大,若此时膜对K+的通透性也增大,将出现很强的外向电流(正离子由膜内向膜外转运时形成的电流),从而引起膜的快速复极化。
为了直接测定动作电位期间膜对离子的通透性变化,在枪乌贼巨轴突上进行了著名的电压钳(voltage Cl-amp)实验。利用电压钳技术,迫使膜电位Em固定(或钳制)在某一水平,从而在电-化学驱动力(Em-Ex)保持恒定的条件下直接记录到了某种离子(X)的膜电流(Ix),这时的跨膜电流变化即可代表膜对该离子通透性的变化,并可根据欧姆定律计算出某种离子的膜电导(Gx),如下式
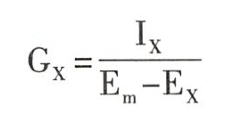
(1)钠电导和钾电导的变化
如图2-18A所示,当枪乌贼大神经纤维的膜电位从-70V突然钳制到-130mV(60mV超极化)时,没有记录到膜电流的变化,表明超极化没有改变膜的通透性;相反,当膜电位由-70mV突然钳制到-10mV(60mV去极化)并保持不变时(图2-18B),可记录首先向下的内向电流,随后转变为向上的外向电流,表明去极化刺激可引起膜电导即膜通透性的改变。
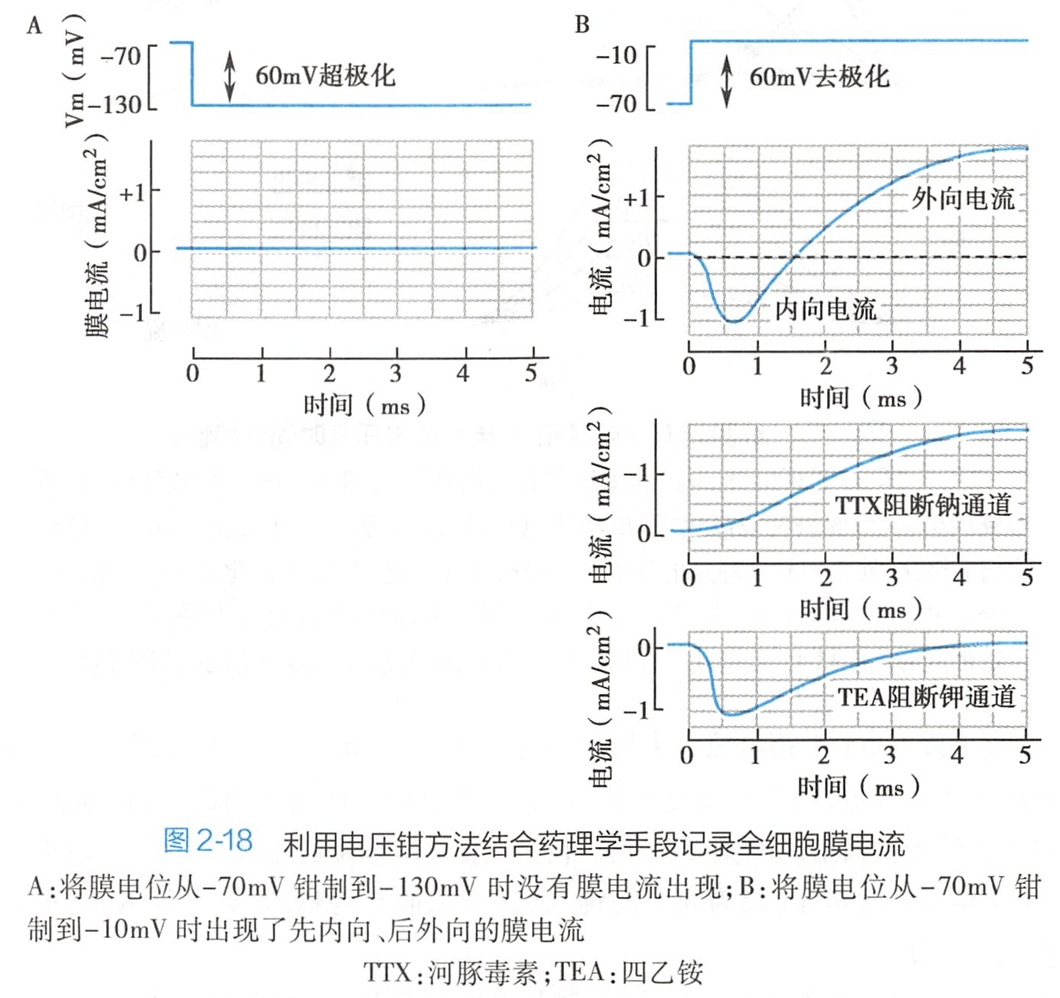
在给予钠通道的特异性阻断剂河豚毒素(tetrodotoxin,TTX)后,只有外向电流存在(图画错了,+1),内向电流消失,表明消失的内向电流是Na+介导的电流;而给予钾通道的特异性阻断剂四乙铵(tetraethylammonium,TEA)后,只有内向电流存在,延迟出现的外向电流完全消失,表明外向电流是由K+所介导。这一电压钳实验表明,去极化刺激可起细胞膜对Na+和K+的通透性增加。
将记录到的膜电流值和被钳制的电位值代入上述2-4式,即可分别计算出膜的钠电导(GNa)和钾电导(GK)。电导反映的是膜对离子的通透性,没有正负之分。
如果利用计算机程序给予细胞内施加一组钳制电压,每次将膜电位钳制于不同的水平并持续一定时间,则可记录到一组幅度不同的电流曲线,计算出不同膜电位下不同的GNa和GK,由此便可同时研究膜电导的电压和时间依赖性。
图2-19所示为四个不同膜电位钳制水平下GNa和GK的变化过程。从图中可见,膜的GNa和GK都有明显的电压依赖性,表现为膜电位去极化程度愈大,GNa和GK就愈大(图2-19A)。
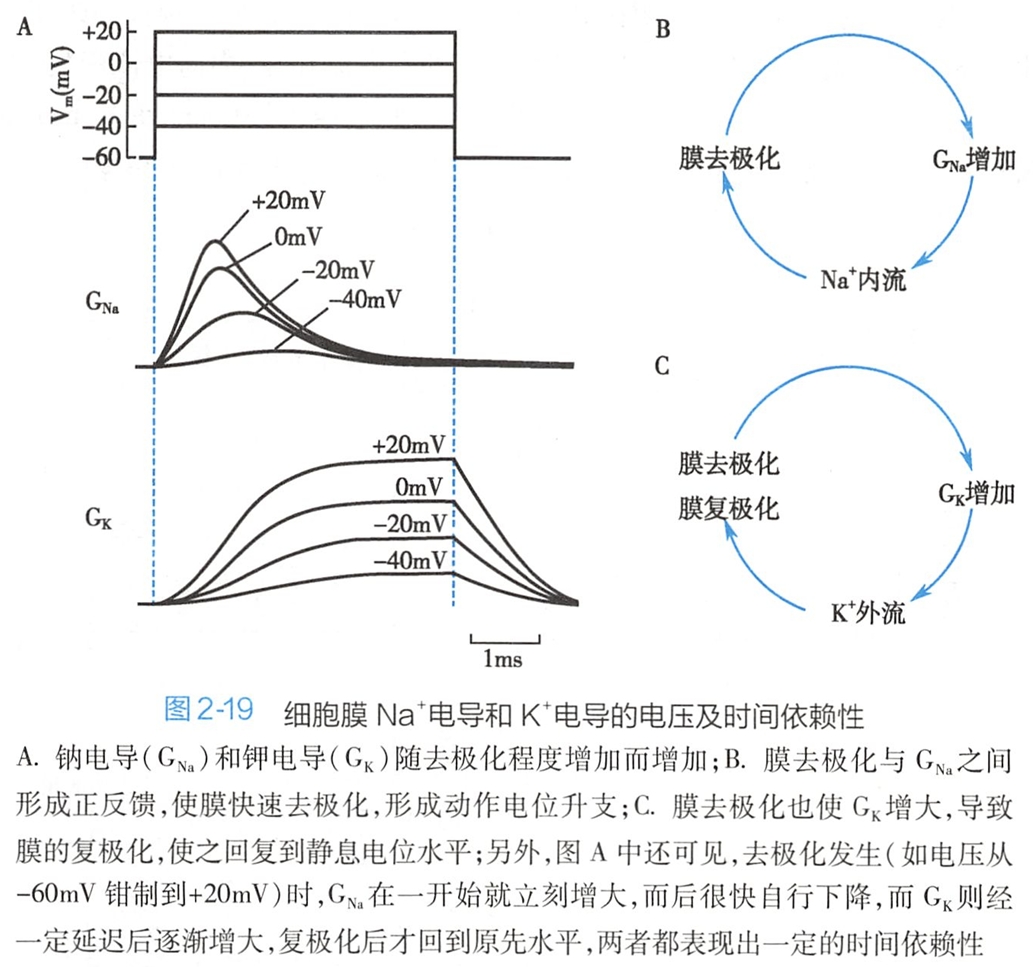
其中,去极化与GNa之间具有互为增强的关系,去极化增强引起GNa增大,GNa增大引起的Na+内流又促进了膜去极化,从而使GNa出现正反馈性激活(图2-19B),这一特征有助于动作电位去极化时相的快速形成,使细胞发生兴奋;去极化与GK之间没有互为增强的关系,去极化虽然可使GK增大,但GK增大后引起的K+外流将促使膜电位快速向静息电位恢复,即复极化(图2-19C),这一负反馈特征有助于兴奋后的细胞迅速回到静息状态。
除了以上电压门控特征外,GNa和GK还表现出明显的时间依赖性。GNa表现为快速(小于1毫秒)一过性激活(电导最大值前为激活,之后为失活),这使Na+内流首先出现,引发了动作电位去极化的产生;GK则在GNa失活时逐渐激活,这使K+外流的增强出现在Na+内流之后,与GNa失活共同作用以加速膜的复极化。
根据以上分析,不难理解细胞在受到刺激后跨膜离子流动和动作电位的产生过程:
- 细胞受到有效刺激时,细胞膜的GNa将首先增大
- Na+在较大的电-化学驱动力推动下流入胞内,使膜发生去极化
- 膜去极化达到一定程度(即阈电位,见后文)后,去极化与GNa之间出现正反馈,膜电位急剧上升,形成动作电位升支,直至接近Na+平衡电位
- 去极化达到峰值后GNa迅速减小、GK逐渐增大
- K+在强大的外向驱动力作用下快速外流,使膜迅速复极化,形成动作电位的降支。
因此,若将细胞外液中的Na+用其他物质取代或给予钠通道阻断剂TTX后,神经纤维动作电位的幅度将下降或消失。
此外,复极化过程中GNa的失活是主要因素,因为膜上的钾漏通道(见前)本身就可以介导K+的外流,GK增大只是进一步加快复极速度。
膜的钙电导也有类似于GNa的电压依赖性和时间依赖性,许多细胞动作电位的升支是Ca2+内流产生的,如平滑肌细胞、某些心肌细胞和内分泌细胞等。
(2)膜电导改变的实质
膜电导即膜对离子通透性变化的实质是膜中离子通道的开放和关闭。
在电压钳工作原理基础上创建了膜片钳(patch clamp)技术,首次记录到了蛙骨骼肌终板膜中ACh受体阳离子通道开放形成的单通道电流(single channel current),证实了膜上离子通道的存在。
与电压钳技术不同的是,膜片钳技术是将微电极下方的一小片膜(可能只包含一个或几个离子通道)进行电压固定,因而可观测单个离子通道的活动(图2-20A)。
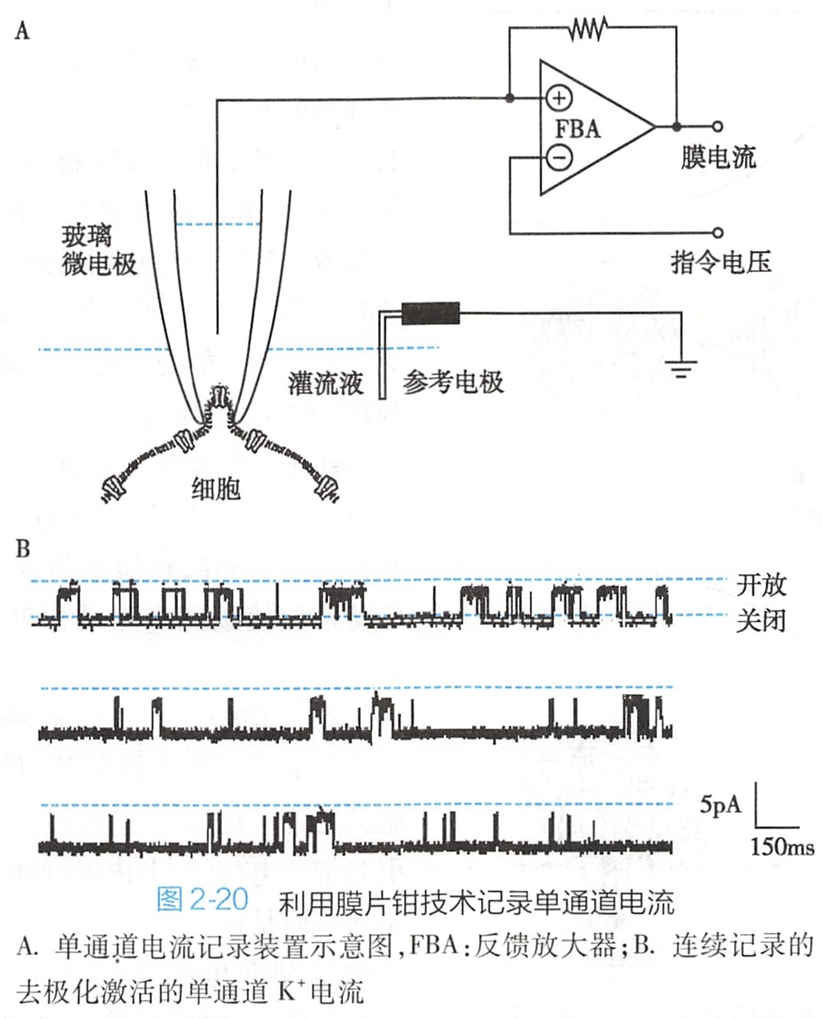
图2-20B所示是采用膜片钳技术记录到的典型的单通道K+电流。单通道的开闭是全或无式的,每次开放可产生皮安级(pA,10-12安培)的电流。由于开放和关闭的转换速度非常快,且开放或关闭的持续时间是随机的,因而单通道电流表现为一个个宽窄不同的矩形波。在全细胞水平记录到的某种离子电流或膜电导的改变,正是膜上大量的单个通道开放或关闭所引起的。
宏膜电流(I)与单通道电流(i)之间的关系可用下式表示

式中N和Po分别为通道开放的数目和通道开放概率。
可见,全细胞电流的变化,与单通道开放的数量、通道的开放概率和单通道的电导都有关。
(3)离子通道的功能状态
根据GNa的电压和时间依赖特性,人们推测神经细胞膜中的电压门控钠通道存在有串联排列的两个闸门(靠近细胞外侧的激活门和靠近细胞内侧的失活门),各自具有不同的动力学特征,由此决定了通道的三种功能状态(图2-21B):
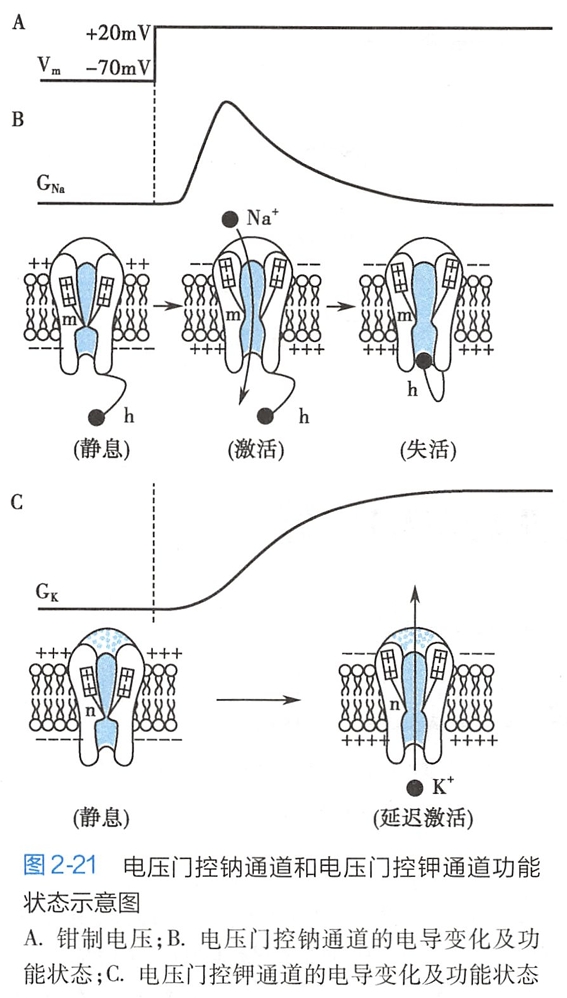
- 静息态(resting state),是膜电位保持在静息电位水平(如-70mV左右)时通道尚未开放的状态。这时,钠通道的激活门(m门)完全关闭,失活门(h门)虽然接近于完全开放,但通道仍不能导通。
- 激活态(activated state),是膜在迅速去极化(如从-70mV改变为+20mV)时电压门控钠通道立即开放的状态。这时,受去极化的影响,钠通道的激活门迅速打开,失活门则逐渐关闭。由于两个闸门的运动速度有明显差异,当激活门迅速开放而失活门尚未关闭时通道出现瞬间导通,膜对Na+的通透性可增加500~5000倍,使Na+电流迅速增大。
- 失活态(inactivated state),是通道在激活态之后对去极化刺激不再反应的状态,这时通道的失活门时间依赖性完全关闭,尽管去极化电压仍继续存在、激活门开放,但通道仍不能导通。通道失活后,只有通过膜的复极化,失活门从通道内口处逐渐退出、激活门返回通道中央,才能使电压门控钠通道返回到原先的“静息态”。
通道从“失活态”回到“静息态”的过程称为复活。可见,钠通道的“静息态”和“失活态”属于稳态,而“激活态”则属于瞬态,是一过性的中间状态。
GK的变化曲线明显不同于钠电导,它在膜持续去极化期间不会自动降低,只有当钳制电压回到起始水平时钾电导才减小。因此,人们推测神经细胞膜中的电压门控钾通道没有失活门,而只有一个激活门(门),通道可有两种功能状态,即安静时激活门关闭的“静息态”和去极化时激活门开放、K+外流的“激活态”(图2-21C)。
电压门控钾通道的激活门在去极化时开放,但反应速度较电压门控钠通道激活门要慢得多,多数是在钠通道失活后才开放,表现为延迟激活。
所以,动作电位期间Na+内流引起的去极化发生在前,K+外流引起的复极化发生在后,两者不会同时发生而相互抵消。
临床上许多药物都是通过作用于离子通道,影响其功能状态而发挥作用的。人类许多遗传性疾病以及自身免疫性疾病也与离子通道功能缺陷有关,形成所谓离子通道病。
(三)动作电位的触发
1.阈刺激
动作电位的产生是细胞受到有效刺激的结果。一般而言,刺激(stimulus)是指细胞所处环境的变化,包括物理、化学和生物等性质的环境变化。
若要使细胞对刺激发生反应,特别是使某些细胞产生动作电位,刺激必须达到一定的量。刺激量通常包括三个参数,即刺激的强度、刺激的持续时间和刺激强度-时间变化率。
由于电刺激的这三个参数很容易控制,且重复性好,对组织的损伤性小,故生理学实验中常选用电脉冲作为人工刺激。
实际测量中为方便起见,常将刺激的持续时间和强度-时间变化率固定,观察刺激强度与反应的关系。
能使细胞产生动作电位的最小刺激强度,称为阈强度(threshold intensity)或阈值(threshold)。
相当于阈强度的刺激称为阈刺激(threshold stimulus),大于或小于阈强度的刺激分别称为阈上刺激和阈下刺激。
所谓有效刺激,指的就是能使细胞产生动作电位的阈刺激或阈上刺激。
2.阈电位
并非任何刺激都能触发细胞产生动作电位。
某些情况下,刺激引起的反应是细胞膜的超极化,如某些神经递质作用于细胞后,可引起带负电荷的Cl-内流,此时细胞产生的反应不是兴奋而是抑制。只有当某些刺激引起膜内正电荷增加,即负电位减小(去极化)并快速减小到一个临界值时,细胞膜的钠电导才能正反馈激活而形成动作电位,这个能触发动作电位的膜电位临界值称为阈电位(threshold potential,TP)(见图2-16)。
一般来说,细胞的阈电位比其静息电位小10~20mV,如神经细胞的静息电位为-70mV,其阈电位为-55mV左右。阈刺激就是其强度刚好能使细胞的静息电位发生去极化达到阈电位水平的刺激。
一定强度的阈下刺激也能引起部分钠通道开放,引起Na+内流而产生轻微的去极化,但由于达不到阈电位水平,其去极化很快被增强的K+外流(钾漏通道介导)所抵消而出现复极化。
当刺激引起的去极化达到阈电位水平时,则K+外流不足以对抗 Na+内流,于是在净内向电流的作用下,膜发生的去极化与Na+电导之间形成正反馈,使膜电位出现爆发性去极化,形成动作电位陡峭的升支。
所以,对那些以钠通道大量开放而触发的动作电位而言,阈电位也可定义为刚好能触发膜去极化与Na+电导之间形成正反馈的膜电位水平。动作电位之所以具有“全或无”特征,其原因是刺激强度只决定膜电位是否能达到阈电位水平,一旦到达阈电位,动作电位的爆发程度如去极化的幅度和速度等则是由钠通道性状本身和离子所受电-化学驱动力大小所决定,而不再与刺激强度变化相关。
影响阈电位水平的主要因素是电压门控钠通道在细胞膜中的分布密度、功能状态以及细胞外的Ca2+水平。钠通道密度较大时,只需较小的膜去极化即可形成较大的Na+电流,因此阈电位水平较低或更接近静息电位,如神经元轴突始段膜中的电压门控钠通道分布密度极高,故始段的阈电位水平明显低于胞体或其他突起部位,亦即兴奋性极高。
电压门控钠通道的功能状态(静息、激活与失活)如前所述。细胞外的Ca2+水平也可影响钠通道的激活。当细胞外Ca2+浓度增高时,可减小膜对Na+的通透性,使阈电位抬高,细胞兴奋性下降,故Ca2+被称为“稳定剂”;相反,细胞外Ca2+浓度降低,可使阈电位下移,向静息电位水平靠近,细胞的兴奋性升高。临床上常见的低钙惊厥正是由此而产生的。
(四)动作电位的传播
1.动作电位在同一细胞上的传播
细胞膜某一部分产生的动作电位可沿细胞膜不衰减地传遍整个细胞,这一过程也称为传导(conduction)。
动作电位传导的原理可用局部电流学说解释。
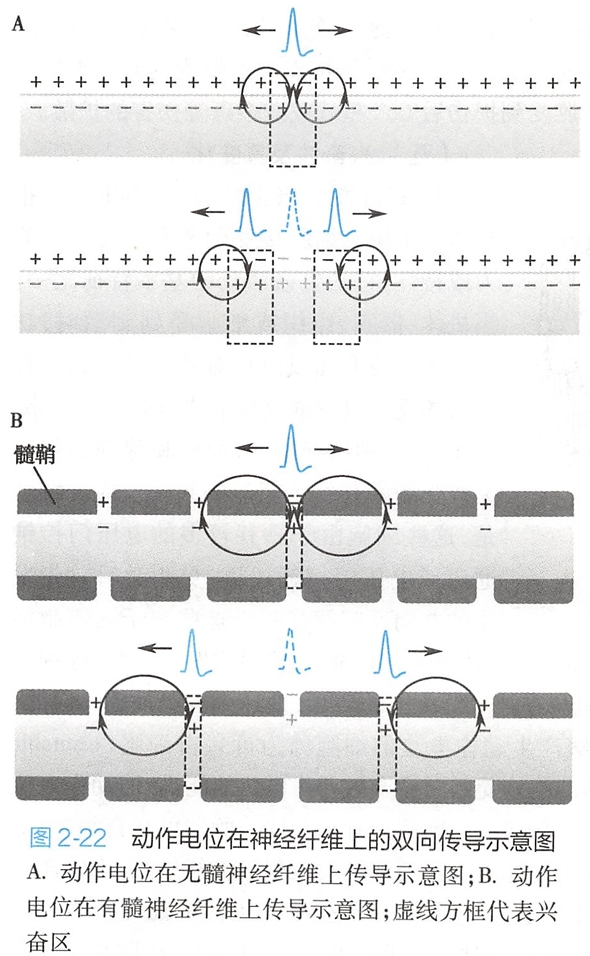
如图2- 22所示,在动作电位的发生部位即兴奋区,膜两侧电位呈外负内正的反极化状态,而与它相邻的未兴奋区仍处于外正内负的极化状态(图2-22A上)。因此,兴奋区与邻近未兴奋区之间将出现电位差,并产生由正电位区流向负电位区的电流。
这种在兴奋区与邻近未兴奋区之间的电流称为局部电流(local current)。局部电流流动的方向在膜内侧是由兴奋区经细胞内液流向邻近的未兴奋区,向外穿过质膜后,又经细胞外液返回兴奋区,构成电流回路。局部电流流动的结果是使邻旁未兴奋区的膜电位减小,即产生去极化,当此处的去极化达到阈电位时即可触发该区爆发动作电位,使它成为新的兴奋区(图2-22A下),而原来的兴奋区则进入复极化状态。
新的兴奋区又与其前方的安静区再形成新的局部电流,恰如多米诺骨牌倾倒一样,一处发生的兴奋将成为下一处兴奋的诱因,从而使动作电位由近及远传播开来。因此,动作电位在同一细胞上传导的实质是细胞膜依次再生动作电位。
神经纤维或肌纤维上传导的动作电位又被称为冲动。如果细胞各部位的质膜对Na+的通透性以及Na+的电-化学驱动力维持不变,动作电位就能不衰减地传导下去。
此外,由于兴奋区和邻旁安静区之间的电位差高达100mV(即动作电位的幅值),是邻旁安静区去极化到阈电位所需幅值(10~20mV)的数倍,故局部电流的刺激强度远大于细胞兴奋所需的阈值,因而动作电位在生理情况下的传导是十分“安全”的。
在无髓神经纤维(图2-22A)或肌纤维,兴奋传导过程中局部电流在细胞膜上是顺序发生的,即整个细胞膜都依次发生Na+内流和K+外流介导的动作电位;而在有髓神经纤维,动作电位的传导则有所不同。
如图2-22B所示,有髓纤维的轴突具有胶质细胞反复包绕形成的髓鞘。髓鞘不是连续的,每隔一段(约1mm)便有一个轴突裸露区(1~2m),即郎飞结(node of Ranvier)。在有髓鞘包裹的区域,轴突膜中几乎没有钠通道,且轴浆与细胞外液之间的膜电阻因胶质细胞膜的多层包裹而加大,因而跨膜电流大大减小,膜电位的波动达不到阈电位。
在郎飞结处,轴突膜中的钠通道非常密集,且轴突膜是裸露的,故跨膜电流较大,膜电位的波动容易达到阈电位。所以,有髓纤维上只有郎飞结处能够发生动作电位,局部电流也仅在兴奋区的郎飞结与相邻安静区的郎飞结之间发生(图2-22B上)。当一个郎飞结的兴奋通过局部电流影响到邻近郎飞结并使之去极化达到阈电位时,即可触发新的动作电位(图2-22B下)。
这种动作电位从一个郎飞结跨越结间区“跳跃”到下一个郎飞结的传导方式称为跳跃式传导(saltatory conduction)。有髓鞘神经纤维及其跳跃式传导是生物进化的产物。
首先,有髓纤维的传导速度比无髓纤维快得多。在无脊椎动物,提高动作电位传导速度的方式是增加轴突直径,因而在枪乌贼出现了直径达1mm的巨轴突;而高等动物则以轴突的髓鞘化来提高传导速度,这使得直径仅4μm的有髓纤维和直径600μm的无髓纤维具有相同的传导速度(25μm/s)。有髓神经纤维最高的传导速度可达100m/s以上,而许多无髓神经纤维的传导速度尚不足1m/s。
其次,神经纤维髓鞘化不仅能提高动作电位的传导速度,还能减少能量消耗。因为动作电位只发生在郎飞结,因而传导过程中跨膜流入和流出的离子将大大减少,它们经主动转运返回时所消耗的能量也显著减少。
临床上发生的多发性硬化症属于一种自身免疫性疾病,其病理改变为有髓神经纤维髓鞘进行性丢失。因此,神经纤维传导速度减慢,甚至完全中断,患者可出现瘫痪或感觉丧失等症状。
2.动作电位在细胞之间的传播
一般而言,细胞之间的电阻很大,无法形成有效的局部电流,因此动作电位不能由一个细胞直接传播到另一个细胞。
但在某些组织,如脑内的某些核团、心肌以及某些种类的平滑肌,细胞间存在缝隙连接(gap junction)。缝隙连接是一种特殊的细胞间连接方式,可使动作电位在细胞之间直接传播。
在缝隙连接处,相耦联的两个细胞的质膜靠得很近(<3nm),如图2-23所示,每侧细胞膜中都规则地排列着一些蛋白颗粒,它们是由六个连接蛋白(connexin)单体形成的同六聚体,称为连接子(connexon)。每个连接子中央有一个亲水性孔道。两侧膜上的两个连接子端端相连,亲水性孔道对接,由此形成连通两个细胞胞质的缝隙连接通道(gap junction channel)。
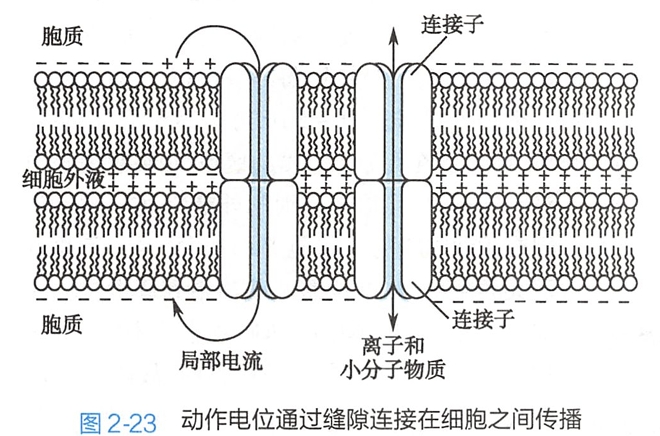
这些缝隙连接通道属于非门控通道,常处于开放状态,孔径1.2~2nm,
允许小分子(分子量小于1.0kD)的水溶性物质和离子通过。在以缝隙连接相连的细胞群中,其中一个细胞产生动作电位后,局部电流可通过缝隙连接直接传播到另一个细胞。
缝隙连接的生理意义在于使某些功能一致的同类细胞快速发生同步化活动,如心肌细胞的同步收缩有利于射血,子宫平滑肌的同步收缩有利于胎儿分娩,呼吸中枢神经元同步兴奋有利于呼吸活动进行等。
神经细胞之间的缝隙连接也称电突触(electrical synapse),与化学性突触相比,电突触具有兴奋传播速度快和双向传播等特点。
当细胞内Ca2+水平增高或pH降低时,缝隙连接通道可关闭,这可防止细胞受到损伤后Ca2+超载或酸中毒等伤害的扩散。
(五)兴奋性及其变化
1.兴奋性
兴奋性(excitability)是指机体的组织或细胞接受刺激发生反应的能力或特性,它是生命活动的基本特征之一。
当机体、器官、组织或细胞受到刺激时,功能活动由弱变强或由相对静止转变为比较活跃的反应过程或反应形式,称为兴奋(excitation)。
神经细胞、肌细胞和腺细胞很容易接受刺激并发生明显的兴奋反应。特别是,这些细胞由于具有较多的电压门控钠通道或电压门控钙通道,受刺激后首先发生的共同反应就是基于这些离子通道激活而产生的动作电位,而后才表现出不同的功能活动形式,如肌细胞经兴奋-收缩耦联发生收缩、腺细胞通过兴奋-分泌耦联引起分泌、神经细胞出现动作电位在神经纤维上的传导,即产生神经冲动。因此,生理学中常将神经细胞、肌细胞和腺细胞这些能够产生动作电位的细胞称为可兴奋细胞(excitable cell)。
对这些可兴奋细胞而言,兴奋性又可定义为细胞接受刺激后产生动作电位的能力,而动作电位的产生过程或动作电位本身又可称为兴奋。
实际上,任何活细胞都具有兴奋性。所谓可兴奋细胞,是因为它们对电刺激较敏感,能以动作电位作为其兴奋的标志。其他细胞对电刺激不甚敏感,不能产生动作电位,但它们对于电刺激以外的其他刺激可能很敏感。
所以,把产生动作电位的能力视为兴奋性、用动作电位本身作为兴奋的定义是相对狭义的,但同时对实验研究也是较方便的。
细胞兴奋性高低可以用刺激的阈值大小来衡量。阈值愈小,兴奋性就愈高;阈值愈大,兴奋性则愈低。例如,普鲁卡因可阻断神经纤维上的电压门控钠通道,使组织阈值增大,兴奋性降低,临床上常用作浸润麻醉。
全面比较组织兴奋性的高低或变化情况,还可测定组织在不同的刺激持续时间下引起组织兴奋所需的强度阈值(两者成反变关系),并由此绘出强度-时间曲线、比较其在坐标轴上的位置用以全面反映组织兴奋性的变化情况。
2.细胞兴奋后兴奋性的变化
可兴奋细胞在发生一次兴奋后,其兴奋性将出现一系列周期性变化(图2-24)。
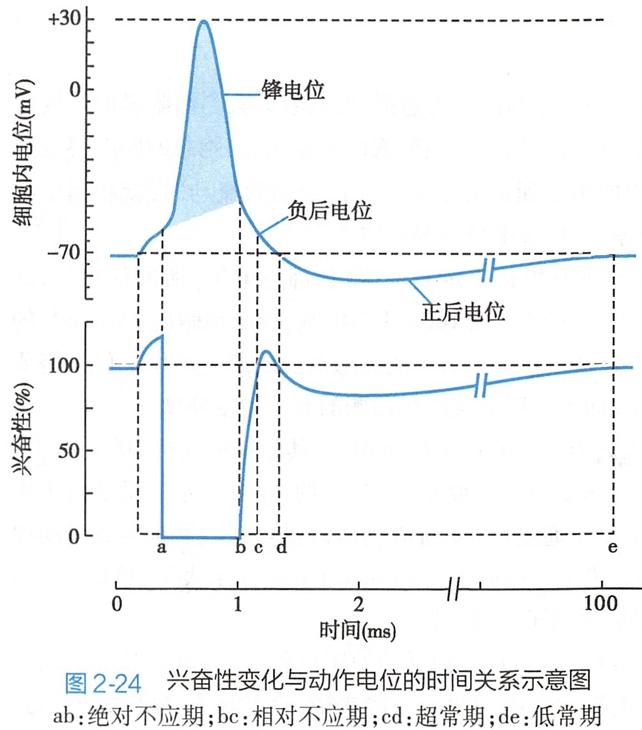
(1)绝对不应期
在兴奋发生后的最初一段时间内,无论施加多强的刺激也不能使细胞再次兴奋,这段时间称为绝对不应期(absolute refractory period)。
细胞于此期的阈值无限大,兴奋性为零,其原因是:兴奋发生的当时大部分钠(或钙)通道已处于激活状态,不存在再激活的问题;兴奋后最初的一段时间大部分钠(或钙)通道已进入失活状态,不可能再次接受刺激而激活。
在神经细胞或骨骼肌细胞,绝对不应期的长短(图2-24中ab)正好对应于锋电位发生的时期,所以锋电位不会发生融合。
同时,锋电位产生的最高频率也受限于绝对不应期的长短。例如,神经细胞的绝对不应期约为2毫秒,故理论上其锋电位的最大频率可达每秒500次。心室肌细胞的绝对不应期约200毫秒,理论上其产生动作电位的最大频率不超过每秒5次。
(2)相对不应期
绝对不应期之后,细胞的兴奋性逐渐恢复,再次接受刺激后可发生兴奋,但刺激强度必须大于原来的阈值,这一时期称为相对不应期(relative refractory period)。
相对不应期是细胞兴奋性从零逐渐恢复到接近正常的时期。此期兴奋性较低的原因是失活的电压门控钠(或钙)通道虽已开始复活,但复活的通道数量较少(部分尚处于复活过程中),因此必须给予阈上刺激才能引发动作电位。
在神经纤维,相对不应期的持续时间(图2-24中bc)相当于动作电位中的负后电位前半段。
由于电压门控钙通道复活所需的时间长于钠通道,因而由钙通道激活形成的动作电位,其不应期也较长。
(3)超常期
相对不应期过后,有的细胞还会出现兴奋性轻度增高的时期,此期称为超常期(supranormal period)。在神经纤维,超常期(图2-24中cd)相当于动作电位中负后电位的后半段。
此时电压门控钠(或钙)通道已基本复活,但膜电位尚未完全回到静息电位,距离阈电位水平较近,因而只需阈下刺激就能使膜去极化达到阈电位而再次兴奋。
(4)低常期
超常期后有的细胞又出现兴奋性的轻度减低,此期称为低常期(subnormal period)。低常期(图2-24中d)相当于动作电位的正后电位部分。
这个时期电压门控钠(或钙)通道虽已完全复活,但膜电位处于轻度的超极化状态,与阈电位水平的距离加大,因此需要阈上刺激才能引起细胞再次兴奋。
三、电紧张电位和局部电位
(一)细胞膜和胞质的被动电学特性
细胞膜和胞质作为一个静态的电学元件时所表现的电学特性,称为被动电学特性,它包括静息状态下的膜电容、膜电阻和轴向电阻等。
1.膜电容
细胞膜脂质双层具有绝缘性,膜两侧是能导电的细胞内液和细胞外液,这种情况类似于一个平行板电容器,因此细胞膜具有电容器的性质。
当一个电容器的两块极板接到电池上充电时,将在一个极板上积聚过量的正电荷,而在另一极板上留下相等的过量负电荷。
其电容(C)可定义为对加于电容器上的每1V电压(V)所积聚的电荷量(Q),即
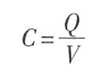
电容器两极板之间的距离愈近,它们分隔并储蓄电荷的能力愈强,即电容愈大。细胞膜的厚度仅约6nm,故膜电容(membrane capacitance,Cm)较大。
此外,细胞膜的表面积愈大,细胞总的膜电容也愈大。多数细胞膜的电容值为1μF/cm2。
当膜中的离子通道开放而引起离子跨膜流动时,就相当于在电容器上充电或放电,从而在膜两侧产生电位差,即跨膜电位或膜电位。
在已知膜电容的基础上,可求得细胞维持一定膜电压(如静息电位)所需的电量,即带电离子的量。经计算,一个直径为10μm、细胞内K+浓度为100mM的细胞,形成细胞内-61.5mV的膜电位,K+只需向细胞外扩散0.004%(不足万分之一)。
可见,形成静息电位或产生动作电位只需要少量离子跨膜移动即可达到一定的膜电位水平,而不会明显扰乱膜两侧的离子浓度梯度。
2.膜电阻
单纯的脂质双层对电流几乎是绝缘的,其电阻高;而生物膜的实际电阻,即膜电阻(membrane resistance)却要小得多。
这主要是由于生物膜的脂质双层中镶嵌着许多导电性能较好的离子通道(如漏通道)和转运体,其数量越多或活动程度越大,膜电阻就越小。
膜电阻通常用它的倒数膜电导(membrane conductance)G来表示,单位是Sie mens,缩写为S。如前所述,膜电导所反映的是膜对离子的通透性。
3.轴向电阻
某些细胞(如神经轴突)的直径较小,其长轴延伸的距离较长,在研究其电活动产生和传导时,还应当考虑这些细胞沿长轴存在的轴向电阻(Ri)。
一般来说,直径越小、轴向延伸的距离越长,轴向电阻就越大。由于质膜兼有电容和电阻的特性,因此可用并联的阻容耦合电路来描述其电学特性。
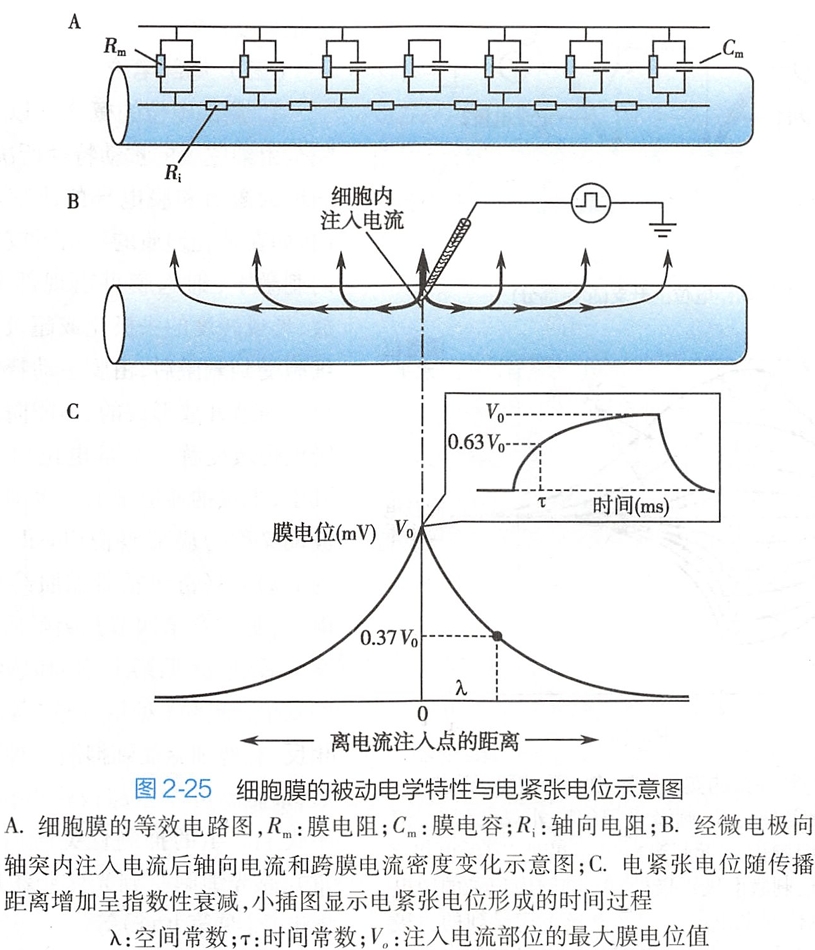
如图2-25A所示,细胞膜可分成许多小片段,每一小片膜都有各自的膜电容和膜电阻,彼此间在膜内由轴向电阻(Ri)相连,在膜外由细胞外液(由于电阻很小,常忽略不计)短路连接。利用这一等效电路,可分析细胞膜在静息时和受刺激时膜电流与膜电位的变化规律。
(二)电紧张电位
1.电紧张电位的概念
由膜的被动电学特性决定其空间分布和时间变化的膜电位称为电紧张电位(electrotonic potential)。
如图2-25B所示,如果在神经轴突的某一点向轴浆内注入一个矩形波脉冲电流(细胞外为零电位),该电流将沿轴浆向两端流动形成轴向电流,同时该电流可以沿途流过细胞膜形成跨膜电流。
由于轴向电阻的存在及不断有电流经原本开放的离子通道(如漏通道)跨膜流出,轴向电流和跨膜电流都将随离开电流注入点距离的增加而逐渐衰减,所产生的膜电位也逐渐衰减,形成一个规律的膜电位分布(图2-25C),即注入电流处的膜电位最大(V0),其周围一定距离处的膜电位将作为距离的指数函数而衰减。
同时,由于膜电容的存在,跨膜电流对其充、放电需要一定时间,这使电紧张电位在任何一处膜上的生成或下降都不能瞬间达到稳定值(图2-25C中的小图)。
2.电紧张电位的传播范围和生成速度
电紧张电位的扩布范围和生成速度可影响动作电位的产生及传导速度。有髓神经纤维上动作电位的传导速度较快,其原因正是轴突被髓鞘包裹后,膜电阻加大、膜电容减小,从而使λ加大、τ减小的缘故。
(1)空间常数
空间常数(space constant)是用来描述电紧张电位传播范围即空间分布特征的参数,常用λ表示,它是指膜电位衰减至最大值的1/e(约37%)时所扩布的空间距离(见图2-25C)。
显然,λ越大,电紧张电位传播的范围和对邻近膜的影响范围就越大。
λ主要受膜电阻和轴向电阻的影响,增大膜电阻(如有髓纤维)或减小轴向电阻(如加大直径),可使λ加大。一般来说,细胞的λ常常较小。
(2)时间常数
时间常数(time constant)是描述电紧张电位时间变化特征的参数,常用τ表示,它是指膜电位在充电时上升到最大值的1-1/e(约63%)或放电时下降到初始值的1/e(约37%)所需的时间(见图2-25C中的小图)。
显然,τ越小,电紧张电位的生成速度就越快。影响τ的主要因素包括膜电阻和膜电容,主要是膜电容,减小膜电容(如髓鞘包裹轴突)可缩短电紧张电位达到稳定值的时间。
3.电紧张电位的极性
电紧张电位可因细胞内注射电流的性质不同表现为去极化电紧张电位(细胞内注射正电荷)和超极化电紧张电位(细胞内注射负电荷)。
如果将正、负两个刺激电极都置于膜外侧(图2-26A),当接通直流电刺激时,则可以在两个电极下方同时产生极性不同的电紧张电位。
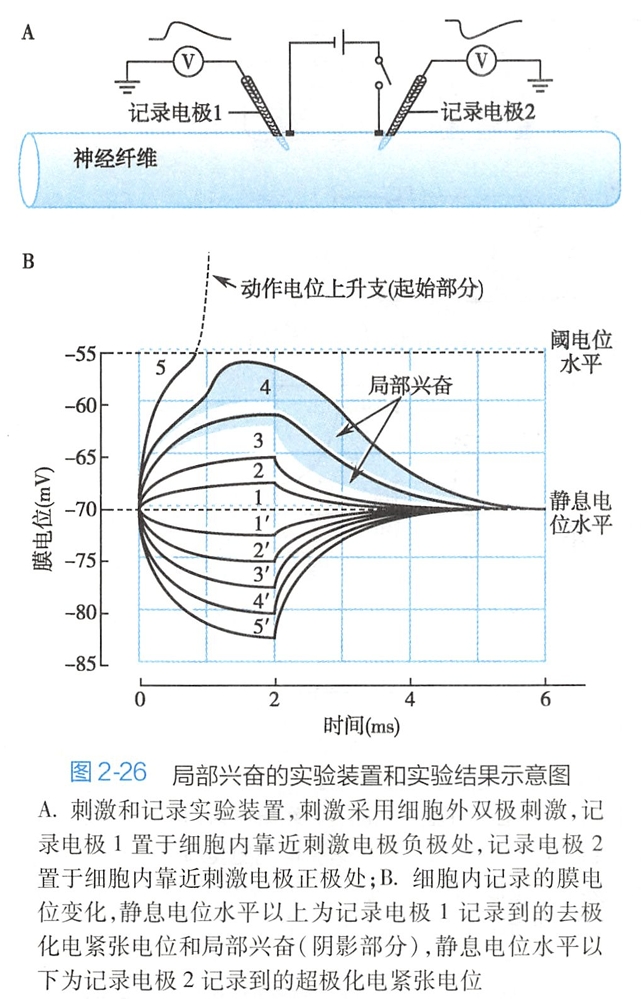
其中,负极下方的细胞膜可以产生去极化电紧张电位,因为胞质内的正电荷会流向负电极的下方,相当于给其胞内注入了正电荷;而正电极下方的细胞膜则产生超极化电紧张电位,因为胞内的负电荷会流向正电极下方,相当于在其胞内注入了负电荷。
这样,当用细胞外电极刺激组织时,只有在出现去极化电紧张电位的负电极下方才可能产生动作电位。
4.电紧张电位的特征
电紧张电位完全由质膜和胞质固有的被动电学特性所决定,其产生没有离子通道的激活和膜电导的改变。与动作电位相比,电紧张电位有以下特征:
- 等级性电位,电紧张电位的幅度可随刺激强度的增大而增大;
- 衰减性传导,电紧张电位的幅度随传播距离的增加呈指数函数下降;
- 电位可融合,由于电紧张电位无不应期,故多个电紧张电位可融合在一起,当去极化电紧张电位的幅度达到一定程度时,可引起膜中少量电压门控钠(或钙)通道开放,形成局部电位(见下文)。
(三)局部电位
1.局部电位的概念
以上电紧张电位完全由细胞膜的被动特性所决定,没有离子通道的激活和膜电导的改变。
但在生物体内,如在神经递质的作用下或在电紧张电位的刺激下,细胞膜可出现部分离子通道开放,形成轻度的去极化或超极化反应。这种细胞受到刺激后,由膜主动特性参与即部分离子通道开放形成的、不能向远距离传播的膜电位改变称为局部电位(local potential)。
其中,少量钠通道激活产生的去极化膜电位波动又称为局部兴奋(local excitation)。体内的局部兴奋包括骨骼肌终板膜上的终板电位(见本章第四节)、突触后膜上的兴奋性突触后电位(见第十章)和感觉神经末梢上的发生器电位(见第九章)等。
与局部兴奋相反,有些细胞受到抑制性神经递质的作用后,细胞膜可发生超极化电位改变,如突触后膜上产生的抑制性突触后电位(见第十章)、感光细胞受到光照刺激后产生的感受器电位(见第九章)等。
去极化电紧张电位可刺激细胞产生局部电位。
如图2-26A所示,用双极电极在细胞外给予神经纤维多次逐渐增大的直流电刺激,可分别在刺激电极的正极和负极附近细胞内记录到膜电位的变化。正极下方的细胞膜受到的是超极化刺激,膜电位发生超极化改变(图2-26B静息电位水平以下部分);负极下方的细胞膜受到的是去极化刺激,膜电位发生去极化改变(图2-26B静息电位水平以上部分)。
图中显示,随刺激强度的增大,正极下方的超极化电位随之成比例增大,表明超极化刺激引起的电位改变完全是基于膜被动特性的电紧张电位。
- 负极下方出现的去极化电位在刺激强度很小(约1/3阈值)时,其幅度与相应刺激强度的超极化电位相同,只是方向相反(图2-26B中1、2和 1'、2'),说明此时的去极化电位改变也是基于膜被动特性的电紧张电位;
- 当去极化刺激进一步增强时(仍然是阈下刺激),膜电位改变的幅度却明显大于相应刺激强度的超极化电位(图2-26B中3、4和 3'、4'),说明这时已有膜主动特性引起的电变化参与到去极化刺激引起的膜电位改变之中。曲线3和4的阴影部分即超出3'或4'的部分正是在去极化电紧张电位的基础上少量钠通道被激活后产生的局部兴奋。
2.局部电位的特征和意义
局部电位具有电紧张电位的电学特征:
- 等级性电位,即其幅度与刺激强度相关,而不具有“全或无”特点;
- 衰减性传导,局部电位以电紧张的方式向周围扩布,扩布范围一般不超过1mm半径;
- 没有不应期,反应可以叠加总和,其中相距较近的多个局部反应同时产生的叠加称为空间总和(spatial summation),多个局部反应先后产生的叠加称为时间总和(temporal summation)。较大的局部兴奋或小的局部兴奋经总和后可使细胞膜去极化达到阈电位,从而引发动作电位(图2-26B中电压变化曲线5)。
局部电位不仅发生在可兴奋细胞,也可见于其他不能产生动作电位的细胞,如感受器细胞。去极化和超极化的局部电位均无不应期,它们可以通过幅度变化、空间和时间总和等效应在多种细胞上实现信号的编码与整合。因而,局部电位是体内除动作电位之外的另一类与信息传递和处理有关的重要电信号。